Hidrojen Nasıl Elde Edilir?
Hidrojen Nasıl Elde Edilir? Hidrojenin Elde Edilmesi
Bilim & Teknoloji
21.04.2013, 22:35 21.04.2013, 23:02
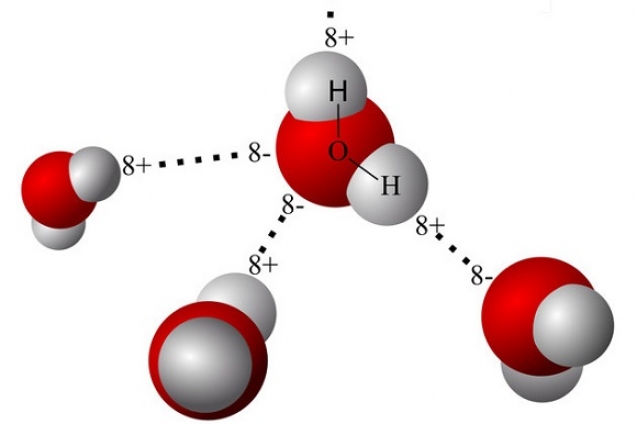
Hidrojenin Elde Edilmesi
Hidrojen evrende bolca bulunan bir malzeme olup,tüm maddelerin yaklaşık olarak ¾’lük bir oranını kapsar.Tüm yıldızlar ve birçok gezegen çok büyük miktarda hidrojen ihtiva eder ancak Dünya üzerinde serbest olarak dolaşan hidrojen miktarı çok düşüktür.Atmosferde yaklaşık olarak onbinde 7 oranında bulunur.Bu yüzden hidrojen üretilmelidir.Hidrojenin yerel kaynakları fosil yakıtlar(CxHy) ve su(H2O) olarak gösterilebilir.Günümüzde hidrojen çoğunlukla doğalgaz,petrol ve kömür gibi fosil yakıtlardan üretilmektedir.
Ancak uzay programları dışında şimdiye kadar hidrojen bir yakıt veya enerji taşıyıcısı olarak pek kullanılmamıştır.Bazı kimyasal ve metalürjik uygulamalar ile rafinerilerde ham petrol yükseltgenmesi gibi işlerde kullanılmıştır.Günümüzde dünya çapında yıllık hidrojen üretimi 40 milyon ton(5,6 EJ) civarındadır.Bir enerji taşıyıcı olarak hidrojen ileriki yıllarda çok daha fazla miktarlarda üretilmeye ihtiyaç duyacaktır.
Fosil Yakıtlardan Hidrojen Üretimi
Doğalgazın Buhar Reformasyonu
Hidrokarbonların(genellikle doğalgaz) buhar reformasyonu hidrojen üretimi için en yaygın,ekonomik ve verimli yöntemdir.Yöntem basitçe 3 ana adım içerir.
1-Gaz Üretim Sentezi 2-Su-Gaz Değiştirmesi 3-Gaz Arıtması
CH4 + H2O » CO + 3H2 ; CO + H2O » CO2 + H2 ; CO + 3H2 » CH4 + H2O
Reformasyon reaksiyonu doğalgaz veya fuel oil’in yanmasıyla oluşan çok güçlü bir endotermik ve enerji sağlayıcı reaksiyondur.Reaksiyon sıcaklığı genelde 700-925 ºC arasındadır. Buhar reformasyon yöntemi verimliliği enerji girişi ve üretilen hidrojen oranı ile hesaplanır ki bu değer yaklaşık olarak %65 ile 75 arasındadır.Üretilen hidrojenin fiyatı yaklaşık olarak 6$/GJ dır.

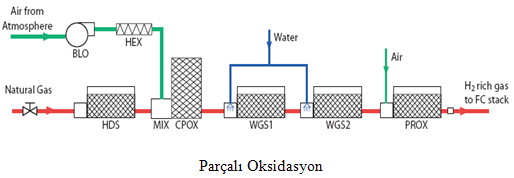
Parçalı Oksidasyon
Parçalı oksidasyon hidrokarbonları neftyağından daha ağır hale çevirmek için kullanılır. Çok yakında doğalgaz,etanol hatta benzinin parçalı oksidasyon dönüştürücüleri otomobil tahrikinde yakıt hücreleri ile beraber kullanılacaklar.Bu işlemde işlem sıcaklığı yaklaşık olarak 1.150 ºC ile 1.350 ºC arasındadır.
Genel olarak parçalı oksidasyonun verimi buhar reformasyonundan düşük olup %50 civarındadır.Hidrojen yaklaşık olarak 10 $/GJ fiyatla üretilebilir.
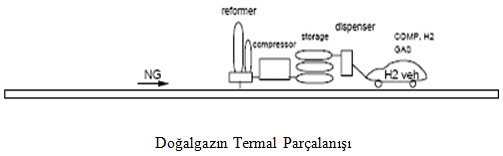
Doğalgazın Termal Olarak Parçalanması
Doğalgazın termal ayrımı uzun yıllardır değişik ürünler elde etmek için kullanılan bir yöntemdir.Bir metan-hava alevi sıcaklığı 1.400 ºC’nin üzerine çıkarmak için kullanılır.Yan ürün(siyah karbon) üretebildiğinden dolayı bu yöntem ekonomik olarak oldukça uygundur. Ayrıca hidrokarbonlardan hidrojen üretiminde CO2 emisyonu sağlamayan tek yöntem olması da dikkate alınmalıdır.
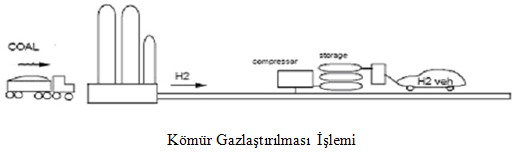
Kömür Gazlaştırılması
Kömür gazlaştırılması işleminde toz haline getirilmiş kömür atmosferik basınç altında oksijen ve buhar ile hızlıca parçalanarak oksidasyona uğratılır.Kömür gazlaştırılması işlemi özellikle katı yakıt taşıma gerekliliği ve büyük miktardaki kül atığından dolayı çok komplike bir işlem halini almaktadır.Genel olarak kömür ucuz bir yakıt olmasına karşın kömür gazlaştırma işlevi hidrojen elde etmek için ucuz bir yöntem değildir.Hidrojen üretim fiyatı yaklaşık olarak 12 $ ile 14 $/GJ arasında değişmektedir.
Biyokütleden Hidrojen Üretimi
Biyokütleden hidrojen bir pirolisis/gazlaştırma işlevi ile elde edilebilir.Biyokütle bir reaktör içinde yüksek sıcaklık ve düşük basınç altında işleme alınır.İşlem sonunda hidrojen,metan ,CO2,CO ve nitrojen elde edilir.Gaz akımlarının yüksek sıcaklıkta bulunmalarından dolayı hidrojen içeriği artar ve bu işlem sonunda oldukça yüksek saflıkta hidrojen elde edilebilir.
Tüm sistem biyokütle hazırlama birimi ve reaktör dizaynı dışında kömür gazlaştırma santraline çok benzer.Ayrıca biyokütlenin daha düşük kalorifik değerinden dolayı kömür gazlaştırma santralinden daha büyük bir alana kurulmuşlardır.

Sudan Hidrojen Üretimi
Elektroliz
Suyun doğru akım kullanılarak hidrojen ve oksijenlerine ayrılması işlemine elektroliz denmektedir. Hidrojen üretimi için en basit yöntem olarak bilinmektedir. İlke olarak, bir elektroliz hücresi içinde, genelde düzlem bir metal veya karbon plakalar olan, iki elektrot ve bunların içine daldırıldığı, elektrolit olarak adlandırılan iletken bir sıvı bulunmaktadır. Doğru akım kaynağı bu elektrotlara bağlandığında akım iletken sıvı içinde, pozitif elektrottan negatif elektroda doğru akacaktır. Bunun sonucu olarak da, elektrolit içindeki su, katottan çıkan hidrojen ve anot tan çıkan oksijene ayrışacaktır. Burada yalnız suyun ayrışmasına karşılık, su iyi bir iletken olmadığı için elektrolitin içine iletkenliği artırıcı olarak genelde potasyum hidroksit gibi bir madde eklenir.
Suyun elektrolizi için, normal basınç ve sıcaklıkta, ideal olarak 1.23 volt yeterlidir. Tepkimenin yavaş olması ve başka nedenlerle, elektroliz işleminde daha yüksek gerilimlerde kullanılır. Hidrojen üretim hızı, gerçek akım şiddeti ile orantılı olduğundan, ekonomik nedenlerle yüksek akım yoğunlukları yeğlenmektedir. Bundan dolayı pratikte suyun ayrıştırılması için hücre başına uygulanan gerilim genelde 2 volt dolayındadır.
Kuramsal olarak, her metreküp oksijen için 2.8 kW-saat elektrik enerjisi yeterli olmakla birlikte, yukarıda özetlenen nedenlerle pratikte kullanılan elektrik enerjisi miktarı bir metreküp hidrojen üretimi için 3.9-4.6 kW-saat arasında değişmektedir. Buna göre elektroliz işleminin verimi %70 dolayında olmaktadır. Ancak, son yıllarda bu alanda yapılan çalışmalar ve gelişen teknoloji sayesinde %90 verim elde edilmiştir. Pratikte kullanılan elektroliz hücrelerinde, nikel kaplı çelik elektrotlar kullanılmaktadır.
Elektroliz bol miktarda hidrojen üretimi için fosil yakıt devrinde geliştirilebilecek olan tek yöntem olarak gözüküyor.Su elektrolizinden hidrojen üretimi 50 yılı aşkın bir süredir bilinen basit bir altyapıya sahip olan,verimliliği yüksek ve hareketli parçası olmayan bir sistemdir.
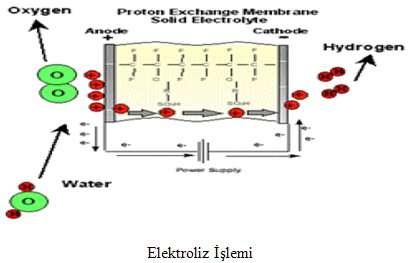
Aşağıda elektroliz reaksiyonu kimyasal olarak verilmiştir.
Katot Reaksiyonu: 2H2O (l) + 2 e¯ » H2 (g) + 2OH¯ (aq)
Anot Reaksiyonu: 2OH¯ (aq) » ½ O2 (g) + H2O (l)
Tüm Hücre Reaksiyonu: H2O (l) » H2 (g) + O2 (g)
Geliştirilen birkaç ileri elektroliz tekniği aşağıda belirtilmiştir;
- İleri alkalin elektrolizler %90’a kadar çıkabilen verimlere sahiptir.
-Katı polimer elektrolitik işlem ise elektrolit olarak proton iletimli bir iyon değişim elemanı kullanır.Bu tip elektrolizörler çok yüksek akımlarda (2 A/cm²) çalışabilirler.
-700-1000 ºC arasında çalışan yüksek sıcaklıklı buhar elektrolizi elektrolit olarak oksijen iyon iletici seramikler kullanır.
Suyun Direk Termal Ayrıştrılması(Termoliz)
Su termal olarak 2000 K sıcaklığının üzerinde ayrılabilir.Bu ayrışma aşağıdaki denklem ile gösterilebilir.
H20 » a H2O +b OH + c H + dO + e H2 +f O2
Ayrışma işleminin sadece % 1’lik kısmı 2000 K de,% 8,5’i 2500 K de ve % 34’ü 3000 K de gerçekleşir.Gazların karışım ürünü oldukça yüksek sıcaklıklardadır.Bu işlemin en büyük problemi reaksiyonu gerçekleştirmek için gerekli olan malzemelerin bu sıcaklığa dayanamamasıdır.İleriki yıllarda daha yüksek sıcaklıklara dayanan malzemeler bulundukça bu yöntem daha yaygınlaşabilir.

Termokimyasal Çevrimler
Hidrojenin termokimyasal üretimi termoliz için gereken sıcaklıktan daha düşük sıcaklıklarla suyun kimyasal parçalanmasına izin verir.1960’ların ortalarından bu yana hidrojen eldesi için 2-3.000 civarında termokimyasal çevrim bulunmuştur.Ancak bunlardan sadece 20-30 kadarı günümüzde hidrojen üretimi için kullanılabilir durumdadır.

Bunlardan bazıları şunlardır;
- Sülfürik Asit-İyot Çevrimi
- Hibrid Sülfürik Asit Çevrimi
- Hibrid Sülfürik Asit-Hidrojen Brömür Çevrimi
- Kalsiyum Bromür-İyot Oksit Çevrimi
Sıcaklığa bağlı olarak değişmekle beraber bu yöntem ile oldukça yüksek (%40-%50) verim elde etmek mümkündür.Ancak kimyasalların saldığı toksik atıklar ve yüksek sıcaklıklarda malzemelerde oluşan korozyon problemi metodun gelişmesi için çözülmesi gereken problemler arasında yer almaktadır.

Fotoliz
Fotoliz sudan hidrojen elde etmek için enerji kaynağı olarak günışığını kullanan bir sistemdir ve fotobiyolojik sistemler,fotokimyasal çeviriciler veya fotoelektrokimyasal hücreler ile desteklenebilir.Bu yöntemle ilgili yeni ve cesaretlendirici çalışmalar yapılmaktadır.
Bor Mineralinden Hidrojen Üretimi
Ülkemiz bor minerallerinin yaklaşık %64’üne sahiptir.Bu miktar doğru kullanılabildiği takdirde çok büyük bir potansiyeldir.Bor minerali endüstride 250’den fazla alanda kullanılmaktadır. Bor 1950’lerden bu yana üzerinde en çok araştırma yapılan minerallerden biridir.Bu noktada bor mineralinin 3 özelliği üzerinde durulabilir.
- Hidrojen taşıyıcısı olarak bor kullanımı
- Hidrojenden daha iyi bir enerji hammadesi olması
- Füzyon reaktörlerinde yakıt olarak kullanımı
Bor üzerinde yapılan araştırmalardan birinde geliştirilen bir teknolojide enerji elde etmek için kullanılan hammadeler saf su ve sodyum bor hidrittir.Sodyum bor hidrit sodyumlu bor tuzunun rafinasyonu sonucu elde edilen ve deterjan sanayinde de kullanılan bir üründür.Geliştirilen bu teknoloji taşımacılığın yanı sıra taşınabilir enerji sağlayıcı piller için de uygulanabilir bir teknoloji olmuştur.Yakıt pillerinde Sodyum borhidritin kullanımı fosil yakıtlardan daha pahalı olan ve eldesi,depolaması,nakli zor olan hidrojenin de dezavantajını ortadan kaldırmıştır.
NaBH4(s)+H2O—>4H2 + NaBO2
Su içerisinde çözünen sodyum borhidrit, bir karışım olarak depolanmakta,enerji üretmek için hidrojene ihtiyaç duyduğunda bu karışım içine tatbik edilen katalizör vasıtasıyla kimyasal reaksiyon başlatılmaktadır.Reaksiyon sonucunda gaz halinde kalan hidrojen ya yakıt pili vasıtasıyla elektriğe dönüştürülmekte ya da doğrudan içten yanmalı motorlarda yakıt olarak kullanılmaktadır.
Geleceğin Yakıtı hidrojen, hidrojen Nedir?>>
15
açık
En Çok Sevdiğiniz Renk Hangisi?
Namaz Vakti
26 Nisan 2024
| İmsak | 04:25 | ||
| Güneş | 06:02 | ||
| Öğle | 13:07 | ||
| İkindi | 16:55 | ||
| Akşam | 20:02 | ||
| Yatsı | 21:32 |
| Takımlar | O | P |
|---|---|---|
| 1. Galatasaray | 33 | 90 |
| 2. Fenerbahçe | 33 | 86 |
| 3. Trabzonspor | 33 | 55 |
| 4. Beşiktaş | 33 | 51 |
| 5. Başakşehir | 33 | 49 |
| 6. Rizespor | 33 | 48 |
| 7. Kasımpasa | 33 | 46 |
| 8. Antalyaspor | 33 | 45 |
| 9. Alanyaspor | 33 | 45 |
| 10. Sivasspor | 33 | 45 |
| 11. A.Demirspor | 33 | 41 |
| 12. Samsunspor | 33 | 39 |
| 13. Ankaragücü | 33 | 37 |
| 14. Kayserispor | 33 | 37 |
| 15. Konyaspor | 33 | 36 |
| 16. Gaziantep FK | 33 | 34 |
| 17. Hatayspor | 33 | 33 |
| 18. Karagümrük | 33 | 33 |
| 19. Pendikspor | 33 | 30 |
| 20. İstanbulspor | 33 | 16 |
| Takımlar | O | P |
|---|---|---|
| 1. Eyüpspor | 31 | 69 |
| 2. Göztepe | 31 | 63 |
| 3. Ahlatçı Çorum FK | 31 | 55 |
| 4. Sakaryaspor | 31 | 54 |
| 5. Bodrumspor | 31 | 52 |
| 6. Kocaelispor | 31 | 52 |
| 7. Bandırmaspor | 31 | 47 |
| 8. Boluspor | 31 | 47 |
| 9. Gençlerbirliği | 31 | 47 |
| 10. Erzurumspor | 31 | 42 |
| 11. Ümraniye | 31 | 37 |
| 12. Manisa FK | 31 | 36 |
| 13. Keçiörengücü | 31 | 36 |
| 14. Şanlıurfaspor | 31 | 34 |
| 15. Tuzlaspor | 31 | 33 |
| 16. Adanaspor | 31 | 32 |
| 17. Altay | 31 | 15 |
| 18. Giresunspor | 31 | 7 |
| Takımlar | O | P |
|---|---|---|
| 1. Arsenal | 34 | 77 |
| 2. M.City | 33 | 76 |
| 3. Liverpool | 34 | 74 |
| 4. Aston Villa | 34 | 66 |
| 5. Tottenham | 32 | 60 |
| 6. M. United | 33 | 53 |
| 7. Newcastle | 33 | 50 |
| 8. West Ham United | 34 | 48 |
| 9. Chelsea | 32 | 47 |
| 10. Bournemouth | 34 | 45 |
| 11. Brighton | 33 | 44 |
| 12. Wolves | 34 | 43 |
| 13. Fulham | 34 | 42 |
| 14. Crystal Palace | 34 | 39 |
| 15. Brentford | 34 | 35 |
| 16. Everton | 34 | 33 |
| 17. Nottingham Forest | 34 | 26 |
| 18. Luton Town | 34 | 25 |
| 19. Burnley | 34 | 23 |
| 20. Sheffield United | 34 | 16 |
| Takımlar | O | P |
|---|---|---|
| 1. Real Madrid | 32 | 81 |
| 2. Barcelona | 32 | 70 |
| 3. Girona | 32 | 68 |
| 4. Atletico Madrid | 32 | 61 |
| 5. Athletic Bilbao | 32 | 58 |
| 6. Real Sociedad | 32 | 51 |
| 7. Real Betis | 32 | 48 |
| 8. Valencia | 32 | 47 |
| 9. Villarreal | 32 | 42 |
| 10. Getafe | 32 | 40 |
| 11. Osasuna | 32 | 39 |
| 12. Sevilla | 32 | 37 |
| 13. Las Palmas | 32 | 38 |
| 14. Deportivo Alaves | 32 | 35 |
| 15. Rayo Vallecano | 32 | 34 |
| 16. Mallorca | 32 | 31 |
| 17. Celta Vigo | 32 | 31 |
| 18. Cadiz | 32 | 25 |
| 19. Granada | 32 | 18 |
| 20. Almeria | 32 | 14 |






































